Что такое временный препарат и как его приготовить

Методика приготовления временных препаратов
- Возьмите из чашки Петри предметное стекло и, держа его за боковые грани, положите на стол.
- Положите в центр стекла объект исследования (тонкие волокна ваты).
- В пипетку наберите немного воды из стаканчика и нанесите на препарат 1-2 капли.
- Возьмите за боковые грани покровное стекло и положите его сверху на предметное стекло (рис. 3).
- Препарат готов. Положите его на предметный столик и рассмотрите под микроскопом.

Вопросы для самоконтроля
- Из каких частей состоит микроскоп МБР-1 ?
- Из чего состоит механическая часть микроскопа?
- Что входит в состав оптической части микроскопа?
- Что входит в состав осветительной части микроскопа?
- Каковы правила работы с микроскопом МБР-1?
- Из каких частей состоит микроскоп МБС-1?
- Каковы правила работы с микроскопом МБС-1?
- Как приготовить временный препарат?
Ключевые слова темы «Устройство микроскопа»
- барабан
- вата
- волокна
- грань
- диафрагма
- зеркало
- изображение
- капля
- конденсор
- макрометрический винт
- механическая часть
- микрометрический винт
- микроскоп
- насадка
- объект
- объектив
- окуляр
- оптическая головка
- оптическая часть
- осветительная часть
- отверстие
- пипетка
- покровное стекло
- поле зрения
- предмет
- предметное стекло
- предметный столик
- препарат
- револьвер
- стаканчик
- тубус
- увеличение
- штатив
Приготовление препарата для микроскопа
В этой статье расскажу 3 способа приготовления препаратов для микроскопа. Эти способы — самые простые.
В начале статьи — так называемый словарик, а точнее пояснения, что такое тот или иной предмет.
Для изготовления микропрепаратов требуется специальный инструмент, красители, а также определенная аккуратность и сноровка. Очень важно строгое соблюдение всех необходимых условий – иначе микропрепарат может оказаться непригодным для исследований.
В продаже есть готовые наборы препаратов для исследований (что удобно для дома и школы) — например, 25 препаратов, или 38 слайдов от Левенгук. А также минералы и другие наборы.
Фиксированный препарат — в микробиологии часто готовят именно фиксированные препараты, так что следует знать, что это такое. Эти препараты рассматривают под микроскопом именно в окрашенном виде. Под словом «фиксация» имеется ввиду такая обработка живого объекта (который вы собираетесь рассмотреть), которая дает возможность быстро прервать жизненные процессы в том или ином объекте (поясню проще — убить), при этом сохранив тонкую структуру. В результате фиксации клетки прочно прикрепляются к стеклу и лучше прокрашиваются. Фиксация необходима в случае работы с патогенными микроорганизмами (в целях самобезопасности).
Патоген, патогенный микроорганизм — живой организм, паразит, вызывающей патологическое состояние (заболевания) иного живого организма.

Суспензия — смесь каких-либо веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе в неосевшем состоянии.
Биологическая петля — тонкая металлическая палочка, на конце — тонкая металлическая петля. Используется для захватывания маленького количества той или иной суспензии микроорганизмов.
Вазелин — мазеобразная жидкость без запаха и вкуса. Смесь состоит из минерального масла и твёрдых парафинов (воскоподобная смесь).
Герметизация — обеспечение совершенной непроницаемости для разных газов и жидкостей поверхностей и мест соединения деталей.
Агар-агар — в микробиологии используется для изготовления плотных и полужидких питательных сред, то есть агаризованных сред.
Жидкость Карнуа — жидкость для фиксации.
Горелка — устройство, имеющее инжектор, который установлен в металлической трубке с отверстиями для поступления в эту трубку атмосферного воздуха, которая закреплена на подставке с боковым вводом для подачи в трубку газа, при этом отверстия выполнены на боковой поверхности трубки, на которой для изменения подачи воздуха в горелку, может быть установлена подвижная заслонка, изменяющая площадь проходного сечения этих отверстий.
Смесь Никифорова — смесь равных объемов этилового спирта и безводного серного эфира, применяется для фиксации мазков крови, мазков-отпечатков органов и каких либо тканей.
Приготовления препарата «раздавленная капля»
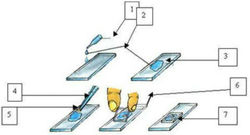
Приготовление препарата «висячая капля»
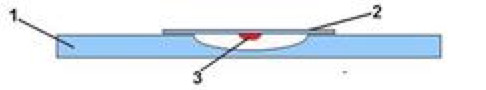
- Одну каплю суспензии микроорганизмов (заранее приготовленной) с помощью биологической петли аккуратно нанесите на чистое покровное стекло.
- Переверните покровное стекло с каплей суспензии так, чтобы капля свободно висела.
- Поместите перевёрнутое покровное стекло с каплей над лункой специального покровного стекла с углублением в центре.
- Капля не должна касаться краёв стекла и углубления (лунки), она должна свободно висеть на покровном стекле.
- Края углубления специального покровного стекла предварительно смазывают вазелином для герметизации камеры.
- Наслаждайтесь наблюдением за бактериями в микропрепарате!
Приготовление препарата «отпечаток»
Из агаризованной среды, на которой какие-либо микроорганизмы растут абсолютным сплошным газоном или же в виде отдельных колоний, аккуратно вырежете скальпелем не очень большой кубик.
Перенесите его на предметное стекло таким образом, чтобы поверхность кубика с микроорганизмами была обращена именно вверх.
Затем к газону микроорганизмов или к колонии приложите обычное покровное стекло (абсолютно чистое), аккуратно и не сильно, а слегка, надавите на него биологической петлей или пинцетом и тотчас снимите, стараясь не сдвинуть его в сторону.
Полученный препарат (покровное стекло с отпечатком) помещают именно отпечатком вниз в каплю обычной воды на чистое предметное стекло. Отпечаток также можно получить и на предметном стекле, если касаться поверхности колонии предметным стеклом.
Приготовление препарата «отпечаток», иной способ
Из агара в чашке Петри с засеянными на нем бактериями (бактериальным газоном) вырежьте блок.
Возьмите обезжиренное чистое стекло и приложите его к поверхности блока агара, засеянного бактериями. Получился первый отпечаток, Отпечатки делайте до тех пор, пока бактериальный слой на блоке не истощится, располагая их слева направо начиная с левой короткой грани стекла.
Приготовление препарата «фиксированный мазок»
Для того, чтобы приготовить этот препарат, требуется на обезжиренное предметное стекло нанести одну каплю воды.
В неё биологической петлей внесите исследуемый вами материал и распределите его так, чтобы получить тонкий и равномерный мазок диаметром примерно 1-1,5 сантиметра (только при таком распределении материала в мазке можно увидеть изолированные бактериальные клетки).
Если исследуемый материал содержится в жидкой среде, то петлей его непосредственно наносят на предметное стекло и готовят мазок. Мазки высушивают на воздухе или в струе теплого воздуха над пламенем горелки.
Для фиксации мазка предметное стекло (именно мазком вверх) очень аккуратно и медленно проводят 3 раза (в течение всего 3 секунд) через пламя горелки. Микроорганизмы, находящиеся в мазке, при фиксации погибают, плотно прикрепляясь к поверхности предметного стекла, и они не смываются при дальнейшей обработке препарата.
Внимание! Более долгое нагревание может вызвать деформацию структур клеток. Мазки крови, мазки-отпечатки органов и каких-либо тканей и (в некоторых случаях и мазки из культур), фиксируют погружением на 5-20 минут в метиловый синий или этиловый спирт, смесь Никифорова, также сулемовый спирт или иные фиксирующие жидкости.
Примеры микропрепаратов для микроскопа
Перечень микропрепаратов набора на 25 слайдов от WSBD World:
Loose Connective Tissue Рыхлая волокнистая соединительная ткань
Spinal Cord c.s. Поперечный срез спинного мозга
Motor Nerve Ending Нервные клеточные окончания (нейроны)
Stomach Mammal Sec. Срез ткани желудка млекопитающего
Kidney c.s. Поперечный срез почки
Artery & Vein c.s. Поперечный срез вены и артерии
Blood Vessel of Lung Срез кровеносного сосуда легкого
Blood Vessel of kidney Срез кровеносного сосуда почки
Tase Bud Вкусовой рецептор
Mouth Smear Мазок со слизистой полости рта
Human Sperm Smear Мазок человеческой спермы
Mitosis of Animal Cell Митоз клетки животного
Hydra thru Testis c.s. Семенник гидры
Hydra thru Ovary c.s. Яичник гидры
Hydra with Bud Гидра с отростком
Fern Prothalium wm Заросток папоротника
Zea Mays Seed l.s. Срез семян кукурузы
Spirogyra Спирогира
Lung Mammal Легкое млекопитающего
Colon Mammal Толстая кишка млекопитающего
Trachea Mammal Трахея млекопитающего
Pancreas Mammal Поджелудочная железа млекопитающего
Uterus Mammal Матка млекопитающего
Spleen Mammal Селезенка млекопитающего
Onion Root Tips Корневые кончики лука
Ботаника и зоология:
Кожица лука
Зерновка ржи
Корневой чехлик
Ветка липы
Пыльник
Завязь
Камелия
Эпидермис листа герани
Конечность пчелы
Крыло пчелы
Циклоп
Вольвокс
Эвглена
Инфузория-туфелька
Дождевой червь (поперечный срез)
Ротовой аппарат комара
Аскарида
Дафнии
Биология и физиология:
Мутация дрозофилы (бескрылая форма)
Мутация дрозофилы (черное тело)
Дрозофила «норма»
Животная клетка
Растительная клетка
Плесень мукор
Дробление яйцеклетки
Митоз в корешке лука
Поперечно-полосатые мышцы
Сперматазоиды млекопитающего
Нерв (поперечный срез)
Рыхлая соединительная ткань
Яйцеклетка млекопитающего
Нервные клетки
Гиалиновый хрящ
Гладкие мышцы
Костная ткань
Кровь лягушки
Кровь человека
Однослойный эпителий
Приготовление препаратов для микроскопирования









Приготовление препаратов для микроскопирования
Препараты для микроскопирования готовят из крови, колоний бактерий, тканей животных и растений и др. В некоторых случаях приготовление препаратов несложно, в других — требует специальной техники.
Наиболее просто готовят так называемые нативные препараты, т. е. объекты в естественном их виде. В этом случае материал наносят на предметное стекло и покрывают тонким покровным стеклом. Иногда его смешивают с изотоническим раствором хлорида натрия или глицерином для разжижения, осветления и предохранения от высыхания.
Широко распространен метод окраски препаратов для микроскопирования. Способ окраски зависит от особенностей исследуемого материала и цели исследования.
Различные части препарата воспринимают краску по-разному, что делает их более четкими, позволяет отличить друг от друга отдельные структуры. Например, мазки крови окрашиваются азур-эозином для подсчета лейкоцитарной формулы, фуксином — для подсчета тромбоцитов, азуром II—для подсчета ретикулоцитов.
Для бактериоскопии — излучения под микроскопом микроорганизмов — существует большое количество методов окраски, в том числе и сложных — двумя и более красителями.
Существует негативный метод окраски, т. е. окрашивается фон препарата, на котором отчетливо видны неокрашенные микроорганизмы, например бледная трепонема.
Препарат для микроскопии не может быть толстым или плотным, так как свет должен хорошо проходить сквозь него, поэтому приготовление гистологических препаратов из тканей требует довольно сложной техники. Ткань обрабатывают спиртами, формалином или фиксирующими смесями, пропитывают целлоидином, парафином или желатином. Затем получают тончайшие срезы ткани при помощи специального прибора — микротома. После этого срезы окрашивают гематоксилин-эозином, Суданом, сложными смесями красителей, серебром и т. д. Срезы закрепляют на предметных стеклах смесью белка с глицерином. Для сохранения препаратов срезы заливают канадским бальзамом и покрывают покровным стеклом. Бальзам засыхает и гистологический препарат может храниться в течение многих лет.
Методика приготовления временных препаратов
Временные препараты так называются потому, что не сохраняются долго. После ознакомления с микрообъектом временный препарат смывается с предметного стекла. Приготовление микропрепарата — один из обязательных видов умений, формируемых в курсе биологии, начиная с 6 класса школьной программы.
Для изучения живых клеток микроорганизмов применяют препараты “раздавленная капля”, “висячая капля”, “отпечаток”, “агаровая пленка” (“микрокультура”). Препараты живых клеток рассматривают с “сухими системами ” микроскопа. Препараты, работа с которыми уже закончена, прежде чем вымыть, выдерживают в дезинфицирующем растворе.
Микропрепараты позволяют проводить широкий ряд опытов. Они предназначены для детального изучения микроскопических структур под микроскопом.
Способы приготовления временных микропрепаратов.
1. Возьмите предметное стекло и, держа его за боковые грани, положите на стол.
2. Положите в центр стекла объект исследования (тонкие волокна ваты).
3. В пипетку наберите немного воды из стаканчика и нанесите на препарат 1-2 капли.
4. Возьмите за боковые грани покровное стекло и положите его сверху на предметное стекло (рис.).
5. Если жидкости много, и она вытекает из-под покровного стекла, удалить ее при помощи фильтровальной бумаги. Если же под покровным стеклом остались места, заполненные воздухом, то добавить жидкость, поместив ее каплю рядом с краем покровного стекла, а с противоположной стороны фильтровальную бумагу
6. Препарат готов.
7. Разместите его на предметном столике микроскопа и рассмотрите его в начале при малом увеличение , а затем при большим.

Этапы приготовление микропрепарата.
Накрывание объекта покровным стеклом.
Препарат устьиц клеток растения.
Приготавливают несколько срезов нижней эпидермы листа и помещают их на 2 часа в 5 %-ный раствор глицерина. Срезы помещают на предметное стекло в том же растворе. Рассматривают препарат.
Затем заменяют глицерин на воду, оттягивая его из-под стекла фильтровальной бумагой. Смотрят, что изменилось.
После этого воду заменяют 20%-ным раствором глицерина или 1М раствором сахарозы. Наблюдают изменения
Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения — моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М.
Приготовление 1 М раствора САХАРОЗЫ.
Молярная концентрация с – отношение количества вещества (в молях), содержащегося в растворе, к объему раствора. Единицы измерения — моль/м3, (моль /л). Раствор, имеющий концентрацию 1 моль/л, обозначают 1 М; 0,5 моль/л, обозначают 0,5 М.
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) · V),
где М(B) — молярная масса растворенного вещества г/моль.
Молярная концентрация измеряется в моль/л и обозначается «M». Например, 2 M NaOH — двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(NaOH) = 40 г/моль).
Какую массу САХАРОЗЫ C12H22O11 нужно взять для приготовления 0,1 литра 1,0 М раствора?
M(C12H22O11) = C(C12H22O11) · V · M(C12H22O11) = 1 моль/л · 0,1 л · 342,29 г/моль » 34,229 г
Таким образом, для приготовления 0,1 литра 1 М раствора нужно взять 34,229 г и растворить в воде, а объём довести до 0,1 литра( довести до 100 мл).
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Препарат КЛЕТКИ СЛИЗИСТОЙ ОБОЛОЧНИ ПОЛОСТИ РТА
Для работы нужны: микроскоп, предметное и покровное стекла, препаровальная игла, скальпель, пипетка, 0,9-процентный раствор NaCl (физиологический раствор), подкрашенный метиленовой синью или чернилами, спирт, вата.
1.Тщательно протрите нетканной салфеткой предметное и покровное стекла.
2.При помощи пипетки нанесите на предметное стекло капельку подкрашенного метиленовым синим, физиологического раствора.
3.Протерев ручку скальпеля спиртом, проведите ею (не лезвием!) несколько раз по внутренней поверхности щеки или нижней губы. Вы снимете немного слизи вместе со слущившимися клетками слизистой оболочки полости рта.
4.Перенесите эту слизь в каплю на предметном стекле при помощи препаровальной иглы, осторожно смешайте слизь с подкрашенным раствором и накройте препарат покровным стеклом.
5.Поместите препарат под микроскоп и рассмотрите его. Найдите слегка окрасившиеся клетки. Рассмотрите в них бледно окрашенную цитоплазму и более темное ядро.
6.Зарисуйте рассмотренные вами клетки в тетради и сделайте надписи.







Методика приготовления постоянных микропрепаратов
Как понятно из заголовка отличие временного препарата, который может храниться относительно не долгий отрезок времени, постоянный препарат может храниться многие годы.
Существуют готовые наборы для изготовления постоянных препаратов, один из таких наборов изображен ниже.
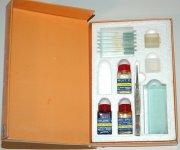


Конечно, данный набор имеет свои ограничения для изготовления препаратов.
Обязательным условием для долгосрочного хранения препарата из растительного или животного материала является его фиксация. Фиксирующих жидкостей много, самые доступные из них: этиловый спирт и продающийся в аптеках препарат на основе формалина (Формидрон) Состав: 100 мл препарата содержат 10 г раствора формальдегида в пересчете на 37 % формальдегид; вспомогательные вещества: спирт этиловый 96 %, одеколон, вода очищенная.
Препарат ФОРМИДРОН, может быть использован для создания архива биологических объектов, вспомогательные вещества входящие в аптечный препарат, не сколько не мешают в сохранении объекта.
ВНИМАНИЕ ФОРМАЛЬДЕГИД ОБЛАДАЕТ РАЗДРАЖАЮЩИМ ДЕЙСТВИЕМ.
Если на дне банки с 40 % формалином образовался осадок белого цвета (параформальдегид), то его можно растворить, подогрев до 70-80 °С (в вытяжном шкафу! или на открытом воздухе), и использовать для фиксации.
Спирт-формол по Шафферу — 10% формалин, который готовят из 1 части 40% формалина и 2-3 частей 96 % спирта. Продолжительность фиксации 24-48 ч. Дальнейшая промывка в воде не требуется, и материал сразу же помещают в 96 % спирт. Выпадение белого осадка никак не сказываеться на свойстве фиксатора.
ПРАВИЛА РАБОТЫ С ФИКСАТОРАМИ
Практически все фиксаторы относятся к токсичным веществам поэтому необходимо соблюдать правила техники безопасности при работе с реактивами.
Фиксация необходима с целью остановки (прекращения) жизнедеятельности клеток. Для этого объект помещают в соответствующий фиксатор на время от нескольких минут до нескольких часов.
ЗАКЛЮЧЕНИЕ ПРЕПАРАТА ПОД ПОКРОВНОЕ СТЕКЛО
Большинство используемых в цитологии и гистологии красителей представляет собой водные растворы. Чтобы сделать временный препарат, срез, вынув из водного раствора красителя, промывают и заключают в глицерин. Приготовить постоянный препарат несколько сложнее: необходимо покрыть срезы покровным стеклом, заключив их в прозрачную затвердевающую среду. Можно, ополоснув срезы дистиллированной водой, капнуть на них разогретый раствор желатины. Но большую сохранность и лучшее качество препаратов можно получить, заключив их в канадский бальзам (прозрачную смолу пихты с показателем преломления n= 1,535). Поскольку канадский бальзам не смешивается с водой, но растворим в ксилоле (толуоле, бензоле), создается необходимость провести препарат по «проводке» для срезов, но в направлении, противоположном тому, в которое стекла велись для удаления парафина и подготовке к окраске. При этом нужно помнить, что даже незначительное присутствие воды в срезе сделает препарат мутным, непригодным для изучения. Поэтому переносить срезы по проводке от воды к толуолу надо медленно, погружая стекло в стаканчик со спиртом или толуолом на 2—3 мин. Схема проведения срезов может быть следующей:
дистиллированная вода — ополоснуть,
спирт 70%-ный — 2 мин,
Ксилол I — 2 мин,
Ксилол II — 3—5 мин.
Надо иметь в виду, что некоторые красители легко вымываются из препаратов как в воде, так и в спиртах. Поэтому в некоторых случаях приходится избегать промывки препаратов и проведения через спирты низких концентраций. Чтобы достигнуть обезвоживания, приходится препараты осторожно промокать фильтровальной бумагой, опуская их сразу в 96%- или 100%-ный спирт, можно заменять этиловые спирты ацетоном или изоамиловым спиртом.
Итак, задача, которая стоит при подготовке препарата для монтирования его под покровное стекло, состоит в том, чтобы, не вымыв красителя, добиться полного обезвоживания среза. Достигается это проводкой по спиртам возрастающей крепости, вплоть до 100%. Обработка срезов ксилолом имеет двоякое значение: с одной стороны, в нем достигается просветление препарата, усиливается его прозрачность (краситель при этом из препарата не вымывается), с другой стороны, создаются благоприятные условия для дальнейшего пропитывания среза канадским бальзамом, который растворим в ксилоле. Само заключение среза под покровное стекло осуществляется быстро, пока на препарате не испарился ксилол. Капля бальзама наносится на покровное стекло (оно должно быть чистым и сухим), и покровное стекло быстро перевертывается над срезом. Можно капать бальзам на предметное стекло на поверхность среза и быстро покрывать его покровным стеклом. Канадский бальзам должен иметь консистенцию растительного масла (или гуще). Через 1—2 дня бальзам застывает.
Вместо канадского бальзама можно использовать синтетическую среду на основе полистирола.
Для этого берут 25г бесцветного полистирола, 5 мл дибутилфталата (пластификатор может быть любой) и доливают ксилолом до 100 мл. Раствор должен иметь консистенцию меда. Заключение среза под покровное стекло не отличается, от выше описанного.
Несомненным плюсом синтетического бальзама это инертность и более лучшая сохранность красителей.
Этапы приготовления постоянного микропрепарата
Что такое временный препарат и как его приготовить

Калькулятор
Сервис бесплатной оценки стоимости работы
- Заполните заявку. Специалисты рассчитают стоимость вашей работы
- Расчет стоимости придет на почту и по СМС
Номер вашей заявки
Прямо сейчас на почту придет автоматическое письмо-подтверждение с информацией о заявке.
Способы приготовления микропрепаратов по биологии
Описание: Подобная конструкция была популярной в викторианской Англии пока Королевское Микроскопическое Общество не представило стандартизированное предметное стекло для микроскопа. Микропрепараты хранят вдали от отопительных приборов и так чтобы предметное стекло находилось в горизонтальном положении.
Дата добавления: 2014-11-04
Размер файла: 1.4 MB
Работу скачали: 204 чел.
Поделитесь работой в социальных сетях
Если эта работа Вам не подошла внизу страницы есть список похожих работ. Так же Вы можете воспользоваться кнопкой поиск
Министерство образования и науки РФ
Государственное образовательное учреждение высшего профессионального образования
«Шадринский государственный педагогический институт»
Кафедра естественнонаучных дисциплин с методикой преподавания
Способы приготовления микропрепаратов по биологии
по специальности 050102 «Биология»
Горшкова Екатерина Андреевна
студентка 3 курса дневного отделения
кандидат биологических наук, доцент
Шарыпова Надежда Владимировна
§ 1. Характеристика микропрепаратов и их использование ………………….4
§ 2. Оборудование, необходимое для приготовления микропрепаратов …….7
§ 3. Подготовка материала для приготовления микропрепаратов …………. 12
§ 4. Способы приготовления микропрепаратов ……………………………….17
Библиографический список …………………………………………………….32
Актуальность темы исследования . Микропрепараты являются наглядным средством обучения и поэтому их широко используют на уроках биологии во время лабораторных занятий, при изучении нового материала, обобщениях, сопоставлениях и опросе.
В связи с недостаточным обеспечением кабинетов биологии готовыми микропрепаратами, которые необходимы для лучшего изучения предмета, их можно изготовить самостоятельно.
Исходя из актуальности, мы выбрали следующую тему исследования: «Способы приготовления микропрепаратов по биологии».
Объектом исследования являются микропрепараты.
Предмет способы приготовления микропрепаратов.
Цель исследования : изучить виды микропрепаратов по биологии и способы их приготовления.
- Изучить и проанализировать литературу по данной теме.
- Дать характеристику микропрепаратов и советы по их использованию на уроках биологии.
- Описать оборудование, необходимое для приготовления микропрепаратов.
- Научиться подготавливать материал для приготовления микропрепаратов.
- Изучить способы приготовления микропрепаратов.
Для реализации целей и задач использовали следующие методы исследования: анализ научно-методической литературы по теме исследования, опытно-поисковая работа и обобщение ее результатов.
Структура курсовой работы . Курсовая работа состоит из введения, 4 параграфов и заключения, представлен библиографический список, включающий 16 источников, 1 приложения.
§ 1. Характеристика микропрепаратов и их использование
К натуральным препарированным пособиям относятся гербарии, влажные препараты, микропрепараты.
Микропрепарат, представляет собой тонкий срез органа живого организма или микрочастицу, заключенный в прозрачный бальзам (иммерсионное масло) или высушенный, помещенный между двумя стеклами (предметным и покровным) [14].
Происхождение микропрепаратов берет начало в использовании слоновой кости или обычной кости в качестве подставки под образцы, которые помещались между дисками прозрачной слюды. Подобная конструкция была популярной в викторианской Англии, пока Королевское Микроскопическое Общество не представило стандартизированное предметное стекло для микроскопа [8].
Микропрепараты позволяют демонстрировать внутреннее клеточное строение организмов, что помогает формированию у учащихся знаний о едином клеточном строении организмов. Микропрепараты можно разделить на две группы:
- постоянные, изготовленные фабричным путем специально для обучения;
- временные, приготовленные учителем для урока или на уроке самими школьниками однократного пользования.
Постоянные микропрепараты представляют собой тончайшие срезы тканей организмов, их органов. Клетки в большинстве своем не имеют окраски и потому, даже при большом увеличении микроскопа, бывает трудно рассмотреть внутриклеточные структуры, в том числе ядро. В связи с этим клеточные микропрепараты окрашивают специальными красителями для придания им большей наглядности. Учителям обязательно надо предупреждать детей о том, что цвет не является естественным для микроструктур. Используют их при изучении нового материала, обобщениях, сопоставлениях и опросе.
Временные препараты так называются потому, что не сохраняются долго. После ознакомления с микрообъектом временный препарат смывается с предметного стекла. Приготовление микропрепарата — один из обязательных видов умений, формируемых в курсе биологии, начиная с 6 класса [14].
Для изучения живых клеток микроорганизмов применяют препараты “раздавленная капля”, “висячая капля”, “отпечаток”, “агаровая пленка” (“микрокультура”). Препараты живых клеток рассматривают с “сухими системами ” микроскопа. Препараты, работа с которыми уже закончена, прежде чем вымыть, выдерживают в дезинфицирующем растворе [4].
Микропрепараты позволяют проводить широкий ряд опытов, предусмотренных программой школьного курса биологии. Они предназначены для детального изучения микроскопических структур под микроскопом.
Преподаватель до работы с микропрепаратом должен четко объяснить учащимся, что они должны увидеть, используя таблицы, рисунки, схемы и т. п.
Во время опроса преподаватели нередко используют «немые», (без этикеток) микропрепараты. Учащимся дается задание определить микропрепараты, рассказать о строении той или иной ткани. Целесообразно хранить одинаковые микропрепараты в одной упаковке, чтобы можно было быстро раздать их учащимся.
Микропрепараты хранят вдали от отопительных приборов и так, чтобы предметное стекло находилось в горизонтальном положении для предотвращения «сползания» микропрепарата [14].
Требования к микропрепаратам:
- Стекла должны быть бесцветными и прозрачными. Покровное стекло должно быть тоньше предметного, которое служит основой изделия.
- Микропрепарат должен быть центрирован, т.е. расположен в середине покровного стекла. Местоположение очень мелкого объекта должно быть отмечено рамкой.
- Микроскопические срезы должны быть очень тонкими и иметь все необходимые для изучения элементы.
- Отдельные ткани микропрепарата должны быть окрашены ярким стойким красителем.
- Микропрепараты должны выпускаться в виде набора для каждого раздела курса биологии. Количество одноименных препаратов в наборе должно быть достаточным для проведения лабораторной работы всеми обучающимися в классе (15-20 шт.).
- К набору микропрепаратов должны быть приложены методические рекомендации, где должны быть приведены рисунки изучаемых микрообъектов и задания для самостоятельной работы учащихся [15].
Рекомендации для учащихся к использованию микропрепаратов
Изучение микропрепаратов в процессе обучения приобщает к методам науки, дает возможность путем непосредственного наблюдения увидеть строение организмов, их частей.
Микропрепараты представляют собой микроскопически малые живые объекты, тончайшие срезы их органов и частей. Эти объекты заключены между покровным и предметным стеклами в специальном растворе. Для лучшей различимости препараты окрашивают, поэтому окраска объектов искусственная.
1. Да начала работы с микропрепаратом требуется записать его название, тему лабораторного занятия.
2. Изучение любого микропрепарата начинают с рассматривания под микроскопом при малом увеличении (56х). Затем выбирают место, где детали лучше видны, и ставят большое увеличение (120-300х) и приступают к зарисовке. При зарисовке микропрепарата надо соблюдать соотношение размерах отдельных частей оригинала. Зарисовка помогает лучше запомнить и создать зрительное представление об объекте.
3. Сначала на рисунке обозначают основные элементы, затем дополняют деталями. Под рисунком подписывают название микропрепарата и увеличение, при котором выполнен рисунок. На одной странице ученической тетради делают 2-3 рисунка. Основные структуры микропрепарата обозначают указателями и напротив каждой пишут цифру с последующей их расшифровкой. Контур поля зрения микроскопа не обозначают [9].
Таким образом, существует 2 вида микропрепаратов временные и постоянные. Их отличие состоит во времени хранения и способах приготовления. Микропрепараты должны отвечать определенным требованиям, которые необходимо тщательно соблюдать. Для приготовления микропрепаратов необходимо специальное оборудование, которое описано в следующем параграфе.
§ 2. Оборудование, необходимое для приготовления микропрепаратов
При отсутствии специального стола с успехом может быть приспособлен любой стол (желательно с ящиками) с площадью рабочей поверхности не менее 60*120см.
Если крышка стола не имеет специального покрытия, то его следует сделать из какого-либо влагоустойчивого материала. Однако участок стола, предназначенный для непосредственной работы по приготовлению препаратов, в любом случае необходимо накрыть стеклом и расположить под ним небольшие (9*12см) листы белой или черной бумаги. Этим создается соответствующий фон, облегчающий работу с окрашенными (белый лист) и не окрашенными (черный лист) объектами. Рекомендуется также на оба листа нанести контуры предметного стекла с обозначением места расположения и размеров покровного стекла.
Для того, что бы удобнее расположить необходимое оборудование, следует иметь двухъярусную полку для реактивов, растворов и посуды, которая устанавливается либо перед работающим (вдоль заднего края стола), либо сбоку в зависимости от расположения стола относительно источника света.
Широкогорлые банки с притертыми пробками различной вместимости от 50 до 200 мл используют для составления гистологических батарей, предназначенных для подготовки кусочков тканей к заливке различными средами. Более крупные банки применяют для фиксации и хранения кусочков тканей в фиксирующих жидкостях, обработки предметных стекол, приготовление нейтрального формалина и пр.
В место банок с притертыми пробками можно использовать небольшие хозяйственные банки с жестяными завинчивающимися крышками, разного объема.
Бюксы небольшие круглые стеклянные стаканчики различного диаметра и высоты с шлифованными крышками.
Биологические стаканчики круглые, овальные или четырехугольные (как и высокие бюксы) применяют для проводки гистологических срезов, монтированных на предметных стеклах. Для придания устойчивости и обеспечения порядка в расстановке их помещают в специальные стойки, изготовленные из дерева или пластмассы, по несколько штук в ряд в зависимости от методики обработки.
Чашки Петри широкие, плоские стеклянные чашки с крышками пригодны для различных манипуляций (окраска свободно плавающих и наклеенных на предметные стекла срезов, использование в качестве подставок под бюксы и т.д.).
Мерная посуда цилиндры и мензурки различной емкости (от 10 до 250-500 мл) воронки различных размеров.
Химические стаканчики круглые стеклянные стаканчики без крышек вместимостью 50-100 мл находят широкое применение при проведении гистохимических реакций, окраски срезов наклеенных на стекла и т.д.
Колбы (плоскодонные) вместимостью от 50 мл до 2 л. Малые колбы применяют для приготовления и хранения растворов различных красителей, большие под дистиллированную воду и прочие жидкости, расходуемые в больших количествах.
Пипетки обычные (предназначенные для закапывания лекарств) используют для накапывания на срезы красителей и различных жидкостей, градуированные (вместимостью 0,1-100 мл) применяют для отмеривания малых количеств различных жидкостей. Можно использовать в настоящее время широко используемые автоматические пипетки различной вместительности.
Предметные стекла прямоугольные пластины размером 76*25 мм толщиной 1,2-1,4 мм, предназначенные для размещения срезов в процессе приготовления микропрепаратов [12]. Более толстые стекла не позволяют получить резкое изображение краев диафрагмы осветителя в плоскости препарата, так как оно оказывается в толще стекла, а это нарушает фокусировку конденсора и резко снижает четкость изображения [4].
Покровные стекла представляют собой тонкие (0,15-0,17 мм толщины, более толстые стекла ухудшают качество изображения) пластинки различных размеров. Служат для покрытия обработанных срезов, расположенных на предметных стеклах. Размеры покровных стекол выбирают в зависимости от площади объекта.
Инструменты, используемые в гистологической лаборатории, включают в себя пинцеты, скальпели, кровоостанавливающие зажимы, корнцанг, бактериологические петли шпатели, препаровальные иглы прямые и изогнутые, металлические и стеклянные. Стеклянные иглы необходимы при импрегнации серебром, когда металлические иглами пользоваться нельзя.
Так же необходимо иметь спиртовку, волосяную кисточку для снятия срезов с микротомного ножа, фильтровальную бумагу, иголки, нитки, плотную бумагу для этикетирования материала, лейкопластырь и карандаш по стеклу [12].
Подготовка предметных стекол.
Предметные стекла, применяемые для получения гистологических препаратов, необходимо предварительно подготовить. Исключение составляют готовые к использованию и специально упакованные импортные предметные стекла.
Предметные стекла моют в теплой мыльной воде или кипятят 15 минут в 2-3 % растворе гидрокарбоната натрия, затем ополаскивают горячей водой и промывают в течение нескольких часов в проточной воде. Вымытые стекла протирают чистой хлопчатобумажной тканью и на несколько дней помещают в 96 % спирт. Обезжиренные стекла извлекают пинцетом из этой смеси, протирают чистой тканью и складывают в коробочку.
Предметные стекла также хорошо обезжириваются в крепком растворе соляной кислоты. Через несколько суток их промывают проточной водой и высушивают.
Качество обезжиривания можно проверить, капнув на предметное стекло воду из пипетки: по обезжиренному стеклу вода растекается тонким слоем, а не собирается в каплю.
Для лучшей фиксации срезов на стекле его предварительно смазывают смесью белка с глицерином. Свежий яичный белок взбивают и фильтруют через крупнопористый фильтр, смоченный дистиллированной водой, затем размешивают с равным объемом глицерина и добавляют несколько кристаллов тимола. Смесь хранится в течение нескольких месяцев. Применяют также смесь, в состав которой входят 15 мл сыворотки крови, 5 мл дистиллированной воды и 6 мл 5 %-ного формалина. После фильтрации смесь готова к нанесению на предметные стекла. Ее использование дает лучшие результаты, чем применение яичного белка, так как при окрашивании не образуется фон.
Для нанесения белка на обезжиренные предметные стекла в одну руку берут 5-6 стекол в виде веера, а в другую чистую стеклянную палочку, которой наносят белок, прикасаясь к каждому стеклу. Затем белок растирают обезжиренным спиртом пальцем по поверхности стекла до его середины, прилагая небольшое усилие. Некоторые авторы рекомендуют натертые белком стекла прогревать в термостате, но опыт показывает, что это излишне, так как после переноса срезов на стекла их помещают в термостат или на специальный столик для просушивания, где одновременно происходит коагуляция белка.
Разработан способ фиксации среза к предметному стеклу без предварительного натирания последнего белком с глицерином.
В ванночку с теплой дистиллированной водой капают несколько капель жидкого казеинового клея и перемешивают. В полученную мутноватую жидкость опускают срезы, расправляют препаровальной иглой и вылавливают на чистое обезжиренное стекло.
Этот способ дает неизменно хороший эффект и вокруг среза отсутствует окрашенный фон, как это часто бывает при применении белка [11].
Таким образом, для приготовления микропрепаратов требуется специальное оборудование и инструменты. Основными из них являются предметное и покровное стекла. Прежде чем начать готовить микропрепарат, необходимо правильно подготовить предметные стекла. К их хранению также предъявляются специальные требования. Но подготовки одного оборудования не достаточно для приготовления микропрепаратов, необходимо также подготовить материалы для исследования. Подробно об этом говорится в следующем параграфе.
§ 3. Подготовка материала для приготовления микропрепаратов
Микропрепараты делятся на временные и постоянные. Подготовка материала для временных препаратов включает фиксацию и окраску.
Фиксация это процесс быстрой консервации клеточных структур, при котором все физиолого-биохимические процессы останавливаются, а водорастворимые вещества переходят в нерастворимое состояние. Следовательно, фиксация позволяет сохранить внутриклеточные структуры в неизменном виде на длительное время. Однако при фиксации в клетках могут появляться артефакты новые структуры, которые отсутствуют в живой клетке, например, разнообразные вакуоли. Для предотвращения появления артефактов необходимо использовать специально подобранные химические растворы фиксаторы, а сама фиксация должна проводиться в определенных условиях. В частности, желательно использовать охлажденные фиксаторы (до 2-3 градусов); для фиксации нужно брать отдельные клетки или кусочки тканей не толще 5мм; объем фиксатора должен превышать объем фиксируемого материала в 50-100 раз; фиксатор не должен использоваться для длительного хранения материала; фиксатор не должен использоваться повторно.
Рассмотрим состав и применение наиболее широко распространенных фиксаторов.
Формалин (формальдегид, или муравьиный альдегид). Наиболее простой и широко распространенный фиксатор. Применяется в виде водных растворов с концентрацией 4-10 %, при этом за 100 % принимается концентрация продажного формалина. Продажный формалин содержит примесь муравьиной кислоты, которую нейтрализуют с помощью углекислого кальция в течение 24 часов. Время фиксации от 1 часа до 24 часов. Для длительного хранения материал переносят в свежий 10 %-ный формалин. Чистый формалин используют в том случае, если планируется дальнейшее изучение локализации и активности ферментов. Чаще же формалин включается в рецептуру более сложных фиксаторов.
Спиртовые фиксаторы. Содержат этиловый или метиловый спирт. Водные растворы спиртов в чистом виде (70 %, 96 % или 100 %) используются относительно редко. Чаще применяют 100 %-ные спирты, которые смешивают с другими веществами. Нужно иметь в виду, что метиловый спирт (метанол) и его пары ядовиты.
В качестве универсальных фиксаторов используют различные композиции на основе формалина, спиртов, органических кислот и неорганических веществ.
Уксусный алкоголь (ацеталкоголь). Это один из наиболее простых фиксаторов. Состоит из 3 частей абсолютного спирта (этилового, а лучше метилового) и 1 части ледяной уксусной кислоты. Для приготовления 100 %-ного (абсолютного) спирта исходные спирты обезвоживают. Для обезвоживания этилового спирта (этанола) используют безводный сульфат меди, а для обезвоживания метилового спирта (метанола) используют оксид кальция. Хранят их в герметичной посуде. Нужно иметь в виду, что все абсолютные спирты особенно ядовиты. Для приготовления ледяной уксусной кислоты исходную концентрированную кислоту охлаждают в холодильнике; при этом кислота замерзает, раньше, чем вода. Жидкость сливают, а замерзшую кислоту оттаивают и используют для приготовления фиксатора. Фиксатор готов для употребления через 24 часа. Хранить фиксатор в темном холодном месте. Время фиксации 2. 24 часа. Затем материал переносят в свежий фиксатор, в котором он может храниться до 1 месяца в холодильнике. Для более длительного хранения материал переносят в 70 %-ный спирт [10].
Фиксатор Карнуа. Состав абсолютный спирт 10 см 3 ; хлороформ 3 см 3 ; уксусная кислота 1 см 3 . Срок фиксации 1-3 часа [1].
Фиксаторы, содержащие пикриновую кислоту, например, смесь Буэна 15 мл насыщенного водного раствора пикриновой кислоты: 5 частей формалина: 1 часть ледяной уксусной кислоты. Этот фиксатор готовят непосредственно перед употреблением. Время фиксации от 1 до 24 часов (иногда несколько суток). Фиксированный материал хранят в 70 %-ном спирте.
Фиксаторы, содержащие сулему (хлорид ртути (II) HgCl 2 ). Сулема используется в виде насыщенного водного раствора в смеси с ледяной уксусной кислотой (25:1), формалином (8,5:1) и более сложных композиций (фиксатор «Суза», фиксатор Ценкера и др.). Время фиксации от 1 до 24 часов. Затем сулему удаляют спиртовым раствором йода (6 частей 70 %-ного спирта:1 часть йодной настойки), а йод удаляют 70 %-ным спиртом. Фиксированный материал хранят в 70 %-ном спирте.
Фиксаторы, содержащие осмий (четырехокись осмия, или осмиевая кислота). Дают наилучшие результаты, используются при изготовлении препаратов, как для световой, так и электронной микроскопии. Можно использовать 1-2%-ный раствор осмиевой кислоты, но чаще применяют композиции, например, фиксатор Флеминга 15 частей 2 %-ной осмиевой кислоты: 1 часть ледяной уксусной кислоты. Фиксация протекает медленно (от 24 часов до нескольких суток).
Кроме перечисленных фиксаторов общего назначения, существуют и специальные фиксаторы. Например, фиксатор для митохондрий содержит 4 части 3 %-ного раствора дихромата калия и 1 часть 40 %-ного формалина. Фиксатор для хлоропластов содержит 15 частей насыщенного раствора медного купороса, 1 часть 40 %-ного формалина и 5 частей воды.
В ряде случаев вместо химической фиксации применяется быстрое замораживание образцов, например, при температуре жидкого азота (196 0 ) или при температуре сухого льда (78 0 ). Замороженные объекты могут быть обезвожены путем возгонки воды в вакууме при температуре ниже 40 0 (этот процесс называется лиофилизация).
Окрашивание позволяет выявлять внутриклеточные структуры, обладающие повышенным сродством к определенным красителям. Красители это относительно низкомолекулярные органические вещества, обладающие повышенным сродством к определенным химическим компонентам клетки.
Существует множество красителей, которые используются для различных целей. Нужно иметь в виду, что выбор красителя связан с характером фиксации и различными методами предварительной обработки клеток.
Названия красителей могут соответствовать получаемой окраске (рубин, кармин, метиловый синий, метиленовый синий, генциановый фиолетовый, метиловый зеленый, оранжевый золотой). Иногда русские названия цветов заменяют на немецкие, например: метилблау, генцианвиолет. В других случаях названия носят отвлеченный, исторически сложившийся характер, например: пиронин, фуксин, сафранин, флороглюцин, судан III. Иногда название красителя не соответствует полученной окраске, например, синий тионин дает фиолетово-красное окрашивание. Довольно редко применяются химические номенклатурные названия красителей, например: диметиламинобензальдегид, 8-амино-1-нафтол-5-сульфокислота.
Различают основные (щелочные), кислотные и нейтральные красители. Основные красители избирательно окрашивают базофильные клеточные структуры (то есть структуры с кислотными свойствами). Кислотные красители избирательно окрашивают ацидофильные, или оксифильные клеточные структуры (то есть структуры со щелочными свойствами). Нейтральные красители окрашивают и базофильные, и ацидофильные структуры.
Наименее токсичные красители используются для прижизненной окраски клеток. Эти красители обычно применяют в виде водных растворов, например: метиленовый синий (концентрация от 1:1000 до 1:10000), трипановый синий (0,5 %-ный раствор), нейтральный красный (от 1:50000 до 1:200000).
Красители для фиксированных клеток могут использоваться в чистом виде (водные или спиртовые растворы, концентрация от 0,1 % до 1 %), например: эозин, фуксин. Часто используют смеси красителей, например, смесь РомановскогоГимза (содержит метиленазур, метиленовый фиолетовый, метиленовый синий и эозин), окраска по Маллори (последовательное использование кислотного фуксина S, а затем смеси анилинового синего и оранжевого золотого G), азурэозин, метилблауэозин.
Однако чаще краситель образуется в ходе его приготовления. Например, широко известное вещество растительного происхождения гематоксилин становится красителем только после его окисления до гематеина. Для окрашивания ядер и хромосом широко используются красители в сочетании с органическими кислотами. Рассмотрим методики приготовления некоторых наиболее простых красителей.
Приготовление 2 %-ного ацетофуксина. 1 грамм основного фуксина растворяют в 50 мл 40 %-ной уксусной кислоты при подогревании на водяной бане.
Приготовление 1 %-ного ацеторсеина. К 1 грамму орсеина добавляют 50 мл ледяной уксусной кислоты и настаивают около 12 часов. Затем смесь нагревают до кипения и добавляют 50 мл дистиллированной воды. Затем нагревают до кипения и охлаждают, повторяя эту процедуру 10 раз. Через сутки краситель фильтруют. Перед окрашиванием на 9 частей красителя добавляют 1 часть 1 н. HCl.
Приготовление 4 %-ного ацетокармина. Раствор готовят в термостойкой колбе с водяным холодильником. 4 грамма ацетокармина смешивают с 100 мл 50 %-ной уксусной кислоты, и кипятят 1 час. Через сутки краситель фильтруют. Аналогичным образом приготавливается ацетолакмоид.
Вместо уксусной кислоты часто используют другие органические кислоты, например, 40 %-ную молочную кислоту.
Все красители после приготовления фильтруют и хранят в темном прохладном месте. Время окрашивания препаратов зависит от температуры (обычно от 20 минут до 1 суток). При нагревании или кипячении время окрашивания сокращается.
Кроме окрашивания органическими красителями отдельные структуры можно выделить, используя их импрегнацию серебром и другими металлами [10].
Таким образом, при приготовлении некоторых временных микропрепаратов необходима фиксация и окраска исследуемого материала. Благодаря этому можно лучше рассмотреть объект под микроскопом. Конкретно о способах приготовления микропрепаратов мы расскажем в четвертом параграфе.
§ 4. Способы приготовления микропрепаратов
При изготовлении временных микропрепаратов необходимо соблюдать следующую последовательность операций:
1. Вымыть и тщательно вытереть предметное и покровное стекла. Чтобы не сломать очень хрупкое покровное стекло, надо поместить его в складку салфетки между большим и указательным пальцами правой руки и осторожно вытереть его круговыми движениями пальцев.
2. Нанести на предметное стекло пипеткой каплю жидкости (воды, глицерина, раствора, реактива или красителя).
3. Сделать срез изучаемого органа при помощи лезвия. Лезвие должно быть очень острым.
4. Выбрать самый тонкий срез, перенести его с помощью препаровальной иглы или тонкой кисточки в центр предметного стекла в каплю жидкости.
5. Закрыть срез покровным стеклом так, чтобы под него не попал воздух. Для этого покровное стекло взять двумя пальцами за грани и подвести под углом нижнюю грань к краю капли жидкости и плавно его опустить.
6. Если жидкости много, и она вытекает из-под покровного стекла, удалить ее при помощи фильтровальной бумаги. Если же под покровным стеклом остались места, заполненные воздухом, то добавить жидкость, поместив ее каплю рядом с краем покровного стекла, а с противоположной стороны фильтровальную бумагу [16].
Перед учителями биологии и руководителями кружков рано или поздно встает задача изготовить учебный микропрепарат. Какое же вещество, способное надолго зафиксировать биологический объект, и как сделать эту процедуру простой и доступной. Известные бальзамы (смолы-фиксаторы) никогда не относились к легкодоступным веществам, особенно в удалении от крупных городов. Кроме того, говорят, что вещества эти не безвредны. И, наконец, сам процесс их использования довольно непрост.
Для изготовления препарата можно использовать клей ПВА. Важно, чтобы препарат был влажный, хорошо смоченный, а клей свежий и чуть разбавленный чистой холодной кипяченой водой до нужной концентрации (клей представляет собою эмульсию и легко разводится). После нескольких проб и ошибок нужную концентрацию получится составлять и определять без труда.
Затем, на чистое предметное стекло наносят каплю воды кипяченой или дистиллированной. Воду надо аккуратно удалить чистой, не оставляющей волосков тканью или фильтровальной бумагой так, чтобы стекло было чуть влажным. Это, как и влажность образца, способствует равномерному (без пузырьков) смачиванию. На подготовленную поверхность нужно нанести небольшую каплю заранее приготовленного клея ПВА так, чтобы не появились пузырьки воздуха. Они иногда и не мешают, но внешний вид препарата портят. В эту каплю аккуратно переносят заранее подготовленный срез или образец, например, предварительно умерщвленную горячей водой дафнию. Затем плавным наклонным движением надо сверху положить покровное стекло, также чистое и слегка влажное. Слой клея между стеклами должен быть как можно более тонким.
Если что-то не удалось, а образец ценный и достаточно крупный, почти всегда, в отличие от смол, есть возможность его отмыть простой водой и процедуру повторить. Излишки клея аккуратно смываются тонкой струйкой воды; нужно следить, чтобы она не затекала между стеклами. Покровное стекло необходимо придерживать. Чуть мутноватые остатки воды можно аккуратно удалить фильтровальной бумагой или полоской тонкой ткани без ворса.
Готовые препараты надо разложить в теплом сухом месте. Индикатором готовности препарата служит его прозрачность. В зависимости от очень многих факторов высыхание до прозрачного состояния продолжается от одной до четырех недель. Бывает, что слишком толстый слой клея или клей, загрязненный примесями, полностью прозрачным не становится это несколько ухудшает изображение, но благодаря небольшой глубине резкости микроскопа даже такие препараты доступны для изучения.
Нет гарантии, что этот метод можно применять для изготовления любых препаратов, поскольку некоторые из них требуют окрашивания, а красители могут взаимодействовать с клеем [7].
Т.Н. Лашкина, учитель биологии и экологии средней школы № 23, из г. Сызрань предлагает следующий способ приготовления микропрепаратов. Можно взять обыкновенный желатин, залить его водой для набухания. Затем в столовую ложку набрать немного набухшего желатина (без воды) и нагреть над огнем. Когда желатин разойдется (не надо, чтобы он закипал), капнуть его на предметное стекло. В эту каплю положить образец и закрыть покровным стеклом, хорошо придавить пальцем его для равномерного распределения желатина. Микропрепарат готов.
Вместо покровного стекла можно использовать целлофан, если нет покровных стекол. Кроме того, целлофан имеет одно преимущество: микропрепарат нельзя раздавить, т.к. целлофан эластичен и не трескается, как покровное стекло.
С желатином надо работать быстро, иначе он застывает. Но если такое случится, то достаточно подержать стекло над огнем и желатин вновь станет жидким. Желатин безвреден, доступен и очень экономичен [13].
Приготовление срезов растений
Для изготовления срезов объект берут большим и указательным пальцами левой руки и при помощи скальпеля или ножа выравнивают его поверхность. В правую руку берут лезвие или бритву и делают им плавное быстрое движение по объекту к себе и вправо (см. приложение рис. 1, А). Срезы должны быть небольшие и тонкие. Их снимают с лезвия мягкой кисточкой и переносят на предметное стекло в каплю среды (см. приложение рис. 1, Б).
Для изготовления срезов мелких объектов последние помещают в сердцевину бузины (см. приложение рис. 2), предварительно сделав в ней разрез или углубление, и проделывают вышеописанную операцию. Лезвие, используемое для получения срезов должно быть острым (должно легко перерезать волос) [1].
Микропрепараты по ботанике
Препарат среза эпидермы с нижней стороны листа традесканции виргинской в капле воды.
Для изготовления препарата лист традесканции обвернуть вокруг указательного пальца левой руки так, чтобы нижняя сторона фиолетового цвета была обращена наружу. Правой рукой при помощи препаровальной иглы надорвать эпидерму над средней жилкой в средней части листа и пинцетом снять ее кусочек. При этом невольно захватывается и часть мякоти листа (мезофилла), но обычно можно найти тонкий участок на периферии, состоящий из одного ряда клеток эпидермы. Сорванный кусочек положить на предметное стекло в каплю воды наружной стороной вверх и накрыть покровным стеклом [16].
Препарат клеток листа элодеи канадской.
В верхней части побега элодеи при помощи пинцета оторвите лист и перенесите в каплю воды на предметное стекло. Лист следует положить нижней стороной к предметному стеклу.
Препарат хромопластов в клетках зрелых плодов.
При помощи препаровальной иглы возьмите маленькие кусочки мякоти зрелых плодов ландыша, рябины и шиповника. Поместите каждый кусочек в каплю воды на предметное стекло и аккуратно разделите клетки. Накройте покровным стеклом.
Препарат крахмальных зерен картофеля.
Разрежьте клубень картофеля. Со свежесрезанной поверхности возьмите скальпелем небольшое количество выступившей жидкости и перенесите в каплю воды на предметное стекло, накройте покровным стеклом.
Препарат каменистых клеток околоплодника груши.
На срезе свежего или фиксированного спиртом околоплодника груши найдите группу каменистых клеток, извлеките их. Поместите на предметное стекло и раздавите кончиком скальпеля.
Нанесите на каменистые клетки каплю 1 %-ного раствора флороглюцина в 50 %-ном этаноле, затем добавьте несколько капель концентрированной соляной кислоты (при работе с концентрированной кислотой следует соблюдать правила техники безопасности).
Одревесневшие оболочки приобретут вишнево-красный или малиновый цвет.
После появления окрашивания удалите реактив фильтровальной бумагой, добавьте каплю глицерина и накройте препарат покровным стеклом [3].
Препарат устьиц клеток растения.
Приготавливают несколько срезов нижней эпидермы листа и помещают их на 2 часа в 5 %-ный раствор глицерина. Срезы помещают на предметное стекло в том же растворе. Рассматривают препарат.
Затем заменяют глицерин на воду, оттягивая его из-под стекла фильтровальной бумагой. Смотрят, что изменилось.
После этого воду заменяют 20%-ным раствором глицерина или 1М раствором сахарозы. Наблюдают изменения (см. приложение рис. 3) [5].
Приготовление микропрепаратов по зоологии
Приготовление препарата простейших организмов сенного настоя.
С помощью стеклянной палочки поместите на предметное стекло каплю раствора метилцеллюлозы.
Пипеткой капните в этот раствор сенный настой. Накройте каплю покровным стеклом. Рассмотрите под микроскопом [ 6 ] .
Приготовление микропрепаратов по физиологии человека
Препарат мазка крови для исследования лейкоцитарной формулы. Каплю крови наносят на сухое предметное стекло (см. приложение рис. 4, а). Шлифовальное стекло устанавливают под углом 45° к предметному. Кровь при соприкосновении со шлифовальным стеклом растекается по его краю (см. приложение рис. 4, б). После этого быстрым движением шлифовальное стекло продвигают вперед, скользя по поверхности предметного стекла. При этом кровь тонким равномерным слоем размазывается по предметному стеклу (см. приложение рис. 4, в).
Хорошо приготовленный мазок крови выглядит на просвет желтоватым, равномерным и прозрачным. В этом случае форменные элементы крови располагаются в нем в один слой [10].
Приготовление микропрепаратов по микробиологи
Приготовление препаратов мертвых клеток микроорганизмов.
Для детального изучения микроорганизмов применяют фиксированные микропрепараты. При фиксации микробов убивают и затем окрашивают.
Приготовление фиксированных препаратов складывается из следующих операций: приготовление мазка, высушивание препарата, его фиксация, окраска и просушивание.
1 этап: Техника приготовления мазков ( см. приложение рис. 5).
- Приготовление мазка с плотной питательной среды
- на обезжиренное предметное стекло наносят петлей небольшую каплю физиологического раствора;
- в правую руку берут бактериологическую петлю, в левую пробирку с культурой;
- петлю стерилизуют, внося ее в пламя горелки в вертикальном положении (накаливание докрасна) (см. приложение рис. 5-1);
- вынимают пробку из пробирки, захватив ее мизинцем правой руки, и обжигают на спиртовке край пробирки (см. приложение рис. 5-2,3);
- петлю вносят в пробирку, охлаждают ее, прикасаясь к стенкам, после чего с поверхности среды снимают небольшое количество культуры (см. приложение рис. 5-4);
- петлю вынимают, не касаясь стенок пробирки, обжигают края пробирки над спиртовкой и закрывают пробкой (см. приложение рис. 5-5,6);
- захваченную микробную культуру вносят в каплю физиологического раствора, тщательно размешивают и равномерно распределяют по стеклу в виде овала, круга или квадрата площадью 1-1,5см 2 (см. приложение рис. 5-7);
- по окончании приготовления мазка петлю вновь стерилизуют (см. приложение рис. 5-8).
- При изготовлении мазка из культур с жидких питательных сред на предметное стекло наносят 1-3 петли исследуемого материала и равномерно распределяют по нему; при этом использование физиологического раствора не требуется. Далее поступают как описано выше.
2 этап: Высушивание мазков.
Приготовленный мазок высушивают на воздухе, над пламенем горелки (но не в пламени), в потоке теплого воздуха или в термостате.
Необходимо знать, что нагревание может нарушить структуру микробов, а так же то, что не до конца высушенный препарат при фиксации окажется испорченным.
3 этап: Фиксация мазков.
Различают физический и химический методы. При фиксации физическим методом стекло с мазком, обращенным кверху, медленно проводят 3-4 раза через пламя. При этом микроорганизмы погибают, мазок прикрепляется к стеклу и не смывается. С недофиксированного мазка микробы смываются, в перефиксированном наблюдается деструкция микроорганизмов, то есть распад на отдельные фрагменты.
Фиксация химическим методом достигается погружением мазков в фиксирующую жидкость, которой может служить:
Спирт-эфир (10-15 мин)
Метиловый спирт (5 мин)
Хлороформ (несколько секунд)
Охлажденный ацетон (5 мин)
4 этап: Окраска мазков.
Окраска микроорганизмов имеет большое диагностическое значение. Она представляет собой сложный физико-химический процесс, в механизме которого существенную роль играют явления адсорбции, капиллярности, химического сродства между красителями и окрашиваемым объектом, рН среды, в которой они находятся.
Различают простые (ориентировочные) и сложные (дифференциальные) методы окраски микроорганизмов.
Простая окраска бактерий выявляет только их морфологию (форму, размер и взаимное расположение микробов). Обычно употребляется только один краситель (метиленовый синий или генциановый фиолетовый). Выделяют позитивный и негативный методы окрашивания.
- Приготовленный и фиксированный мазок помещают в специальный мостик над ванночкой.
- Наносят какой-либо краситель на определенное время (количество краски должно быть таким, чтобы покрыть всю поверхность мазка, достаточно нескольких капель). При этом необходимо следить, чтобы краситель на мазке не подсыхал, в случае необходимости на мазок наливают новые порции красителя.
- Затем тщательно и быстро промывают водой.
- Высушивают фильтровальной бумагой.
- Наносят каплю иммерсионного масла и микроскопируют.
Мазок считается качественным, если бактерии расположены изолированно друг от друга и равномерно окрашены.
При этом методе окрашивается фон мазка, а микроорганизмы остаются неокрашенными. Он применяется для исследования микроорганизмов, оболочки которых плохо воспринимают анилиновые красители (лептоспиры, спирохеты).
- На край предметного стекла наносят каплю туши и смешивают ее петлей с каплей культуры.
- Мазок делают ребром шлифованного предметного стекла аналогично приготовлению мазка крови (см. приложение рис. 6). Предметное стекло кладут на горизонтальную поверхность и придерживают левой рукой; правой рукой к капле придвигают под углом в 45 0 шлифовальное стекло, по краю которого равномерно растекается капля; сразу же, плотно прижимая шлифовальное стекло в том же положении под углом, продвигают его налево по предметному стеклу, получая равномерный мазок.
- Дают высохнуть и микроскопируют.
Дифференциальная (сложная) окраска.
Сложные, или дифференциальные способы окраски бактерий основаны на особенностях физико-химического строения микробной клетки. Позволяют, применяя несколько растворов красителей и реактивов, определить морфологические свойства и структурные компоненты клетки (споры, капсулы, жгутики и др.).
Одним из важнейших методов является окрашивание микробов по Граму. Это универсальный дифференциально-диагностический метод окраски, предложенный датским ученым Грамом в 1884г. Он используется в качестве одного из ключей в определителях микробов.
Окрашивание микробов по Граму.
Грампринадлежность микробов зависит от химического состава бактериальной клетки и строения клеточной стенки.
- На фиксированный мазок кладут небольшой кусочек фильтровальной бумаги и наливают раствор генцианвиолета на 1-2 минуты.
- Снимают бумагу, сливают краску и, не промывая водой, наливают на препарат раствор Люголя на 1 минуту (мазок чернеет).
- Обработка мазка спиртом в течение 30 секунд (погружают в стаканчик 2-3 раза).
- Промывают водой.
- Дополнительно окрашивают разведенным фуксином в течение 1-2 минут.
- Сливают краску, промывают водой, обсушивают фильтровальной бумагой, исследуют с иммерсионной системой.
Грамположительные микроорганизмы окрашиваются фиолетовым цветом, не обесцвечиваются спиртом и не воспринимают основной фуксин. Грамотрицательные микроорганизмы обесцвечиваются спиртом и приобретают розово-красный цвет от окрашивания фуксином.
Обнаружение капсул методом негативного контрастирования.
Небольшое количество клеток с твердой питательной среды помещают петлей на предметное стекло в каплю разбавленного фуксина, смешивают с каплей туши, накрывают покровным стеклом и рассматривают под микроскопом. На сером фоне препарата хорошо видны бесцветные капсулы, окружающие клетки микроорганизмов окрашены в розовый цвет.
- На фиксированный мазок наливают метиленовый синий (по Леффлеру).
- Краситель доводят до кипения, держа предметное стекло пинцетом над пламенем горелки. По мере испарения красителя его добавляют. Продолжительность окраски трехкратная, по 10-15 секунд.
- Предметное стекло охлаждают и тщательно промывают водой.
- Дополнительно в течение 30 секунд докрашивают 0,5%-ным водным раствором сафранина (или фуксина Циля).
- Краситель сливают, препарат промывают водой, сушат и рассматривают под микроскопом.
При правильном окрашивании вегетативные клетки имеют красный, а споры синий цвет (светло-розовый).
5 этап: Просушивание.
Оставшуюся на стекле после промывания воду осторожно удаляют фильтровальной бумагой, или отсасывая ее краем бумаги, или слегка прижимая кусочек бумаги к мазку. Окрашенный мазок должен быть совершенно сухим, так как остаток воды образует с кедровым маслом, нанесенным на мазок, мутную эмульсию, что мешает микроскопированию.
Приготовление препаратов живых клеток микроорганизмов.
Метод изучения микробов в живом неокрашенном состоянии имеет следующие преимущества:
- Микробы изучаются в неповрежденном виде.
- Наблюдение микробов в живом виде позволяет выявить ряд свойств, не обнаруживаемых у убитых микробов (активная подвижность).
Вместе с тем метод имеет и ряд недостатков:
- Трудность исследования неокрашенных микробов ввиду их малой величины.
- Невозможность длительно сосредоточит внимание на микробе, так как он быстро перемещается из поля зрения.
В живом состоянии микробов исследуют в “раздавленной капле”, “висячей капле” и “отпечатком”, также рассматривают “агаровую пленку”; в некоторых случаях при этом применяют прижизненную (витальную) окраску микробов [2].
Препарат “раздавленная капля”.
На предметное стекло наносят каплю воды, помещают в нее небольшое количество клеток изучаемых микроорганизмов, размешивают и накрывают покровным стеклом. Микроорганизмы, выращенные и на плоской и в жидкой питательной среде, переносят в каплю воды бактериологической петлей; выращенные в жидкой среде можно переносить так же стерильной пипеткой. При продолжительном изучении микроскопируемого объекта края покровного стекла рекомендуется залить лаком для ногтей, что предотвратит быстрое высыхание препарата (см. приложение рис. 7).
Препарат “висячая капля”.
Каплю суспензии микроорганизмов петлей или обычным пером наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна свободно висеть, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят в жидкой питательной среде. При работе с бактериями используется редко (см. приложение рис. 8).
Из агаризованной среды, на которой микроорганизмы растут сплошным газоном или в виде отдельных колоний, вырезают скальпелем небольшой кубик и переносят его на предметное стекло так, чтобы поверхность с микроорганизмами была обращена вверх. Затем к газону или колонии прикладывают чистое покровное стекло, слегка надавливают на него петлей или пинцетом и тот час же снимают, стараясь не сдвинуть в сторону. Полученный препарат помещают отпечатком вниз в каплю воды или метиленового синего (1:40) на предметное стекло. Отпечаток можно получить и на предметном стекле, если касаться поверхности колонии или газона предметным стеклом. Используют в основном при исследовании спороношения стрептомицетов.
Препарат “агаровая пленка” (или “микрокультура”).
На тонкое простерилизованное и нагретое предметное стекло наносят стерильной нагретой пипеткой 0,2-0,3 мл горячей агаризованной питательной среды и распределяют по всей поверхности стекла. После застывания среды удаляют петлей лишний агар, оставляя два тонких участка пленки, величиной с покровное стекло каждый. В центр квадратов бактериальной петлей или пипеткой наносят каплю жидкой культуры или суспензии клеток микроорганизма. Стекло помещают во влажную камеру (чашка Петри со слоем мокрой фильтровальной бумаги), которую ставят в термостат. Перед микрокопированием на пленку с выросшей микрокультурой наносят каплю красителя или каплю воды в случае подсыхания пленки и затем осторожно накрывают покровным стеклом [4].
Прижизненная окраска микробов.
При работе с раздавленной каплей для лучшей видимости микробов жидкость можно слегка подкрасить, вводя под покровное стекло небольшую каплю красителя. При этом бактерии окрасятся и будут отчетливее видны в поле зрения микроскопа.
1 способ окраски:
- На чистое предметное стекло наносят насыщенный водный раствор метиленовой сини.
- Дают высохнуть.
- Фильтровальной бумагой протирают стекло, пока налет не примет светло-голубого оттенка.
- На предметное стекло наносят каплю исследуемого материала и накрывают покровным стеклом.
- Микробы постепенно окрашиваются в голубой цвет, оставаясь живыми.
2 способ окраски:
Каплю исследуемого материала смешивают на предметном стекле с краской (0,1-0,01%), накрывают покровным стеклом и рассматривают под микроскопом [2].
Таким образом, мы изучили, какие существуют способы приготовления как временных, так и постоянных микропрепаратов, из каких организмов их можно приготовить. Выяснили, что микропрепараты широко используются во всех биологических науках.
Изучение научной и методической литературы позволило нам сделать выводы о том, что микропрепараты широко используются на уроках биологии и для этого необходимо уметь их изготовлять.
Микропрепараты делят на временные и постоянные. Временные препараты не хранятся, их готовят в ходе лабораторной работы, непосредственно перед изучением объекта. Постоянные препараты могут храниться много лет. В основном их изготавливают промышленным путем, но можно их приготовить и самостоятельно.
К микропрепаратам предъявляют определенные требования по изготовлению, хранению и использованию, которые необходимо соблюдать.
Перед занятием учитель должен проинструктировать учащихся как правильно обращаться с микропрепаратами.
Для приготовления микропрепаратов по биологии необходимы специальное оборудование и инструменты: предметные стекла, покровные стекла, пипетки, чашки Петри, различные колбы, препаровальные иглы, пинцеты, скальпели, спиртовки и др. К оборудованию, используемому при приготовлении микропрепаратов, так же как и к самим микропрепаратам предъявляются требования по хранению и подготовке, которые тоже нужно соблюдать.
Иногда, материал для микропрепаратов нужно зафиксировать и окрасить, для чего используются специальные красители и фиксаторы.
Микропрепараты можно приготовить различными способами. Это и приготовление срезов, мазков, отпечатков, и приготовление микропрепаратов живых клеток организмов (висячая капля, раздавленная капля, отпечаток, агаровая пленка) все это временные микропрепараты. Материалом для них могут быть различные части растений, ткани, микроорганизмы.
